Синдром полікістозних яєчників в практиці андролога
Різні патологічні процеси, що об'єднуються терміном « синдром полікістозних яєчників «, — наступна після гіперпролактинемії найважливіша причина ановуляторного безпліддя.
у таких хворих може мати місце тільки ановуляція, але іноді (як у першого хворого, описаного Штейном і Левенталем) спостерігається ожиріння, гірсутизм і олігоменорея.
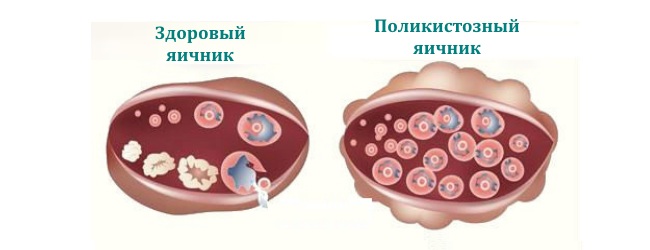
Типові зміни в яєчниках, через які хвороба отримала своє назва, також спостерігаються не у всіх випадках. Зазвичай яєчники збільшені в 2,8 раз і оточені гладкою перлинно-білої капсулою.
Кількість прімордіальних фолікулів не змінюється, але число дозрівають і атрезірованних фолікулів подвоюється, так що кожен яєчник містить від 20 до 100 кістозних фолікулів, що просвічують крізь капсулу. Оболонка приблизно на 50% товще звичайною. Обсяг клітин хілус збільшений в 4 рази, корковий і підкоркових шари строми розширені.
Раніше помилково вважали, що СПКЯ має чисто яєчникові походження. Насправді ж анатомічні зміни в яєчниках — наслідок порушення їх гормональної регуляції з поступовим формуванням порочного кола.
Синдром може мати гипоталамические, гіпофізарні, яєчникові і / або надниркових причини, і дисфункція всіх цих органів часто супроводжується олиго- або аменореей, гірсутизм і безпліддям.
Полікістоз розвивається в яєчниках тоді, коли овуляція відсутня протягом тривалого часу. Таким чином, СПКЯ — це не діагноз, а лише характерна форма хронічної гіперандрогенної ановуляции. Нещодавно показано, що причиною синдрому служать порушення секреції андрогенів і регуляції їх біосинтезу. Зміни морфології яєчників абсолютно недостатні для діагнозу.
В яєчниках багатьох жінок, навіть за відсутності гормональних зрушень, під капсулою знаходять більш восьми кіст діаметром менше 10 мм. Як показують епідеміологічні дослідження, приблизно у 25% жінок пременопаузального віку УЗД виявляє типові ознаки СПКЯ.
Аналогічні ознаки при УЗД виявляються навіть у 14% жінок, що користуються пероральними контрацептивами. Ановуляція на цьому тлі спостерігається не більше ніж в 5-10% випадків.
У патогенезі СПКЯ найважливіша роль належить підвищеної продукції андрогенів. Біосинтез стероїдів в яєчниках і в корі надниркових залоз у жінок підпорядковується тим самим закономірностям, що і у чоловіків. Продукується яєчниками андростендион служить попередником як тестостерону, так і естрогенів.
На відміну від чоловіків, у жінок андрогени не пригнічує секрецію ЛГ і АКТГ за механізмом негативного зворотного зв'язку, оскільки є лише побічними продуктами синтезу естрогенів і кортизолу . Основну роль відіграє внутрияичникового регуляція продукції андрогенів. Андрогени в яєчниках представляють собою «необхідне зло». З одного боку, без них неможливий синтез естрогенів і зростання дрібних фолікулів, але з іншого — їх надлишок перешкоджають відбору домінантного фолікула і викликає його атрезію .
Характер секреції стероїдів у хворих з СПКЯ свідчить про загальну дисрегуляции продукції андрогенів, зокрема — на рівні 17-гідроксилази і 17,20-ліази. Порушення регуляції можуть зачіпати продукцію андрогенів тільки в яєчниках, тільки в надниркових залозах або в обох органах. Синдром ПКЯ може бути наслідком гіперандрогенії і чисто наднирковозалозної генезу.
Порушення правильного ритму секреції гонадотропінів і статевих стероїдів обумовлює постійну ановуляцию. Рівні тестостерону, андростендіону, сульфату дигідроепіандростерону, 17-гидроксипрогестерона і естрону в сироватці зростають.
Підвищений рівень естрогенів не пов'язаний з їх безпосередньою секрецією яєчниками. Добова продукція естрадіолу у жінок з СПКЯ не відрізняється від такої у здорових жінок в ранню фолікулярну фазу. Підвищення концентрація естрогену в сироватці обумовлено посиленим перетворенням андростендиона в естрон в жировій тканині.
При хвороби полікістозних яєчників відношення ЛГ / ФСГ зазвичай перевищує 3, однак у 20-40% хворих таке зрушення в співвідношенні гонадотропінів відсутня. Секреція ЛГ зберігає імпульсний характер. Амплітуда окремих імпульсів (12,2 ± 2,7 мОД / мл) вище, ніж на початку або середині фолікулярної фази нормального циклу (6,2 ± 0,8 мОД / мл). Мабуть, це результат зміни частоти імпульсів ГнРГ.
Підвищення амплітуди імпульсів ГнРГ при постійній їх частоті призводить до зниження периферичної концентрації ФСГ , що не позначаючись на рівні ЛГ. Це і обумовлює типовий зсув співвідношення гонадотропінів. Таким чином, в основі характерного для СПКЯ зміни коефіцієнта ЛГ / ФСГ лежить порушення частоти і амплітуди секреції ГнРГ, а не первинне порушення секреції Л Г.
На гипоталамическую продукцію ГнРГ впливають ендогенні опіати. При СПКЯ знаходили зміни в метаболізмі ендорфіну. ? -ендорфін І адренокортикотропний гормон (АКТГ) утворюються з єдиного попередника, проопиомеланокортина (ПОМК).
Відомо, що в ситуаціях, що супроводжуються підвищенням продукції АКТГ, зростає і рівень? Ендорфіну. У хворих з СПКЯ концентрації АКТГ і кортизолу нормальні, що не виключає прискорення їх метаболізму. Оскільки рівень? Ендорфіну при стресі зростає, а хворі з СПКЯ відчувають психологічний стрес, можна припустити існування єдиної причини порушення центральних регуляторних механізмів.
Описане вище вплив гіперпролактинемії на центральні механізми гормональної регуляції може пояснювати часте поєднання СПКЯ з гіперпролактинемією.
Високі концентрації тестостерону знижують рівень глобуліну, що зв'язує статеві гормони (ГЗСГ). Тому у жінок з полікістозних яєчників зміст ГЗСГ внаслідок вторинної гіперандрогенії зазвичай знижено вдвічі. Це супроводжується підвищенням концентрації вільних естрогенів, що знову-таки корелює зі зростанням відносини ЛГ / ФСГ.
Підвищена концентрація вільного естрадіолу і периферичний перетворення андростендіону в естрогени зумовлюють зниження рівня ФСГ, проте залишкової кількості ФСГ все ж вистачає для продовження стимуляції яєчників і утворення фолікулів в них.
Проте дозрівання фолікулів не закінчується овуляцією. Дрібні фолікули дозрівають дуже повільно, протягом декількох місяців, що призводить до утворення фолікулярних кіст розміром 2-6 мм.
Гіперплазована тека в умовах безперервної гонадотропной стимуляції постійно продукує стероїди. Порочне коло замикається, і захворювання триває. Після загибелі фолікулів і розпаду гранулези шар теки зберігається, що (згідно вищеописаної двоклітинного теорії) призводить до збільшення продукції тестостерону і андростендіону.
Підвищений рівень тестостерону ще більше знижує вміст ГЗСГ, внаслідок чого зростає концентрація вільних естрогенів. Одночасно збільшується фракція вільного тестостерону, що впливає на андрогенозалежні тканини.
Инсулинорезистентность — ожиріння — безпліддя
Приблизно у 40% жінок з синдромом ПКЯ є інсулінорезистентність. Хоча в її генезі можуть грати роль ожиріння і вік, порушення толерантності до глюкози при СПКЯ спостерігається навіть за відсутності ожиріння і у молодих жінок. Інфузія глюкози викликає надмірну секрецію інсуліну .
Встановлено, що з інсулінорезистентністю пов'язано майже 10% всіх випадків порушення толерантності до глюкози при СПКЯ. До 15% хворих на діабет II типу страждають СПКЯ.
Хоча андрогени можуть викликати легку інсулінорезистентність, їх концентрація при СПКЯ недостатня для індукції порушень метаболізму інсуліну. Гальмування продукції андрогенів не повернуться до нормальних чутливості до інсуліну. І навпаки, прийом андрогенів (наприклад, при зміні статі з жіночого на чоловічий) лише незначно збільшує ступінь інсулінорезистентності.
В будь-якому разі при підвищеному рівні інсуліну в крові збільшується його зв'язування рецепторами ІФР-I на клітинах теки. Це посилює стимулюючу дію ЛГ на продукцію андрогенів. Таким чином, підвищений рівень інсуліну в крові посилює продукцію андрогенів. Одночасно він знижує вироблення в печінці ГЗСГ і ІФР-зв'язуючого білка-I. Хоча є свідчення про підвищення секреції інсуліну при гіперандрогенії, більшість даних свідчить про те, що гіперінсулінемія передують порушенню метаболізму андрогенів, а не навпаки.
Ожиріння . Оскільки збільшення маси тіла і абдомінальної жирової тканини супроводжується гиперинсулинемией і зниженням толерантності до глюкози, можна припустити, що саме ожиріння відіграє основну роль в патогенезі СПКЯ.
Типове для жінок відкладення жиру в області стегон в набагато меншому ступені впливає на розвиток гіперінсулінемії. Об'єктивним показником розподілу жиру в організмі служить відношення об'єму талії до об'єму стегон. Якщо це відношення перевищує 0,85, кажуть про андроїдному розподілі жирової тканини, що сприяє гиперинсулинизме. При відносно менше 0,75 швидше за все має місце гіноідное розподіл, яке рідко поєднується з порушеннями метаболізму інсуліну.
Діагностика синдрому полікістозних яєчників
При ановуляції без клінічних ознак ПКЯ переконатися в реальній відсутності цього синдрому допомагають в основному гормональні дослідження. Всупереч колишнім уявленням, типова картина при УЗД недостатня для встановлення діагнозу. До лікування слід підходити індивідуально, враховуючи результати визначення рівнів тестостерону, андростендіону, ДГЕАС , естрадіолу, ЛГ, ФСГ і пролактину в першу половину циклу. При підозрі на надпочечниковую патологію визначають також вміст кортизолу і 17-ОН-прогестерону.
Лікування синдрому полікістозних яєчників
При СПКЯ зазвичай має місце підвищений рівень андрогенів і естрогенів, а також інверсія відносини ЛГ / ФСГ. Лікування повинне бути спрямоване на «розрив» сформованого порочного кола з тим, щоб забезпечити можливість овуляції.
Застосовуються наступні форми лікування синдрому полікістозних яєчників:
- антіестрогени (наприклад, кломифен),
- глюкокортикоїди (дексаметазон 0,25-0,5 мг / сут.),
- імпульсна введення ГнРГ за допомогою спеціального насоса,
- стимуляція мГ,
- хірургічне видалення частини яєчникової строми ,
- пероральні антидіабетичні засоби.
Перші три форми терапії розраховані на корекцію зворотних зв'язків в системі регуляції дозрівання фолікулів. На відміну від цього, МГ або ХГ діють безпосередньо на рівні яєчників, і тому їх застосування пов'язане з високим ризиком гіперстимуляції. До хірургічного видалення строми яєчників, яка продукує андрогени, слід вдаватися тільки при неефективності інших видів лікування.
Після терапії кломіфеном овуляція з'являється у 63-95% хворих з СПКЯ. Кломифен є слабкий антиестроген і викликає підйом рівнів гонадотропінів. Препарат зазвичай призначають по 50 мг / сут. протягом 5 днів (з 3 по 7 день менструального циклу). Це дозування відновлює овуляцію у 27-50% хворих.
Іноді дозу доводиться підвищувати до 150 мг / сут., Що призводить до овуляції ще у 26-29% жінок. Якщо ж і при цьому дозуванні овуляція не відновлюється, можна додатково призначити дексаметазон по 0,25-0,5 мг / сут. в залежності від концентрації ДГЕА-сульфату в сироватці.
У тому випадку, коли результати УЗД і гормональні дослідження свідчать про дозріванні фолікулів, а овуляція відсутня, її можна індукувати ХГ в дозі від 5000 до 10 тис. ME в / м. Оскільки в нормі зачаття в перші 3 місяці спільного життя відбувається лише у 50% подружніх пар, а через рік — у 80%, остільки після нормалізації лютеїнової фази (за даними УЗД і гормональних досліджень) лікування слід продовжувати, щонайменше, протягом 6 місяців або циклів.
Кломіфеновая терапія дозволяє домогтися успіху в 90% випадків безпліддя, обумовленого синдромом ПКЯ.
МГ і ФСГ . При безуспішності кломіфеновой терапії переходять до наступного етапу — введенню гонадотропінів . При гіперандрогенії ефективність такого лікування нижче, ніж при чисто гипоталамической формі аменореї.
Так як для СПКЯ характерна висока чутливість до стимулюючого ефекту МГ, необхідно дотримуватися тонку грань між індукцією овуляції і гиперстимуляцией, що загрожує багатоплідної вагітністю. Поява очищених препаратів ФСГ породило надію на можливість корекції відносини ЛГ / ФСГ, що мало б підвищити ефективність терапії, проте клінічне застосування очищеного ФСГ поки не виправдало цих надій.
Перевага нових препаратів ФСГ полягає в можливості їх підшкірних ін'єкцій. Неконтрольовані дослідження свідчать про більшу ймовірність зачаття і меншій частоті гіперстимуляції при використанні таких препаратів.
« знижує регуляція » рецепторів ГнРГ. Стимуляція МГ і ХГ часто призводить до передчасного піку ЛГ з лютеинизацию фолікула. Деякі автори вважають це основною причиною пізніх викиднів, що нерідко спостерігається при СПКЯ. Однак така точка зору не має чіткого клінічного підтвердження. Тому при використанні МГ і ХГ рекомендувати «знижує регуляцію» рецепторів ГнРГ необов'язково.
Импульсное введення ГнРГ . Масштабні дослідження, проведені в 1980-х рр., Показали, що така терапія забезпечує відносно високу ймовірність вагітності, не збільшуючи ризику гіперстимуляції. Імпульсне введення ГнРГ (при резистентності до кломифенцитрат) призводить до виникнення вагітності в 26% на цикл. Попередня «знижує регуляція» дозволяє збільшити цей показник до 38%, до такого ж рівня зростає і частота викиднів.
Клиновидна резекція яєчників . Якщо всі перераховані види терапії не приводять до виникнення вагітності, рекомендують клиновидную резекцію яєчників, знижує продукцію андрогенів яєчникової стромой. Після такої операції овуляція відновлюється майже у 90% хворих.
Приблизно у третини з них на наступний рік розвивається оліго- і / або аменорея. Імовірність зачаття падає до 1,8% на цикл, що може бути пов'язано з утворенням післяопераційних спайок. Мікрохірургічна і ендоскопічна термокаутерізація, лазерна вапоризації або електрокоагуляція, мабуть, дозволяють уникнути цього ускладнення. Серед 100 хворих, які перенесли електрокоагуляцію яєчників, частота вагітностей склала 70%.
Пероральні антидіабетичні засоби . Для подолання інсулінорезистентності застосовували метформін і троглітазон. При цьому дійсно спостерігалося зниження рівня андрогенів і відновлення овуляторних циклів. Поки цей вид терапії не може бути рекомендований до широкого застосування, тим більше що в Америці троглітазон вилучено з продажу.
Низька маса тіла і дозрівання фолікулів . Незалежно від перерахованих вище способів терапії, першочерговим завданням лікування огрядних хворих з СПКЯ має бути зниження маси тіла.
Ризик порушення дозрівання фолікулів і аменореї збільшується не тільки при високій, але і при низькій масі тіла. Останнє характерно для великої групи хворих з гипоталамической аменореей і порушенням імпульсної секреції ГнРГ.
У таких випадках необхідно виключити патологію гіпофіза. Гіпоталамічна регуляція порушується не тільки при явному дефіциті ваги, але і внаслідок психологічного стресу (наприклад, відхід від чоловіка або зміна партнера). При цьому спостерігаються вкрай низькі концентрації гонадотропінів. Рівень пролактину і картина турецького сідла залишаються нормальними. Модифікований прогестероновий тест (G-фарлютал 5 мг двічі на добу протягом 10 днів) не викликає кровотечі, що свідчить про відсутність естрогенної стимуляції ендометрія.
Найяскравіший приклад аменореї, пов'язаної з низькою масою тіла, — нервова анорексія . У клініках, що займаються безпліддям, чиста форма анорексії зустрічається вкрай рідко, але більш «м'які» її форми спостерігаються частіше.
На відміну від нервової анорексії, супроводжується змінами регуляторних механізмів в центральній нервовій системі, дозрівання фолікулів може порушуватися і при простий втрати ваги, на що не завжди звертають увагу.
Гормональні зрушення в цих випадках схожі з такими при нервової анорексії: низькі концентрації ФСГ і ЛГ, підвищений рівень кортизолу, нормальний вміст пролактину, ТТГ і тироксину, рівень вільного Т3 — на нижній межі норми, підвищений вміст реверсивного Т3.
Різка втрата ваги супроводжується випаданням пов'язаних зі сном епізодів секреції ЛГ (подібно до того, що спостерігається на ранніх стадіях статевого дозрівання). Стан хворих покращується, коли маса тіла відрізняється від ідеальної не більше ніж на 15%.
Регуляція циклічної функції яєчників залежить не тільки від маси тіла, а й від фізичної активності. Неодноразово показано, що у спортсменок, особливо у стаєр і балерин, порушується менструальна функція.
Частота випадків аменореї пропорційна відстані, пробігає за тиждень, і обернено пропорційна масі тіла. Зниження маси тіла супроводжується почастішанням ановуляторних циклів і погіршенням якості лютеїнової фази. В основі порушення секреції ГнРГ лежать зрушення в метаболізмі естрогенів: естрадіол перетворюється в катехолестрогени, які володіють, мабуть, антиестрогенами властивостями.
Підвищення фізичної активності (наприклад, при бігу) супроводжується «сп'янінням бігунів», обумовленим, як вважають, збільшенням рівня ендогенних опіатів. Ці речовини підвищують концентрацію кортикотропин-рилізинг гормону, що, в свою чергу, знижує секреціюгонадотропінів.
Продукція гипоталамического ГнРГ, мабуть, падає. Налтрексон (в дозі 25-125 мг / сут.) Нормалізував менструальний цикл у 49 з 66 жінок з порушенням гіпоталамічної регуляції дозрівання фолікулів. Вагітність наступала майже в такому ж відсотку випадків, що і у здорових жінок контрольної групи. Альтернативою може бути імпульсна терапія ГнРГ або стимуляція яєчників МГ і ХГ, але при цьому слід враховувати ризик багатоплідності. В першу чергу потрібно нормалізувати масу тіла.